데이터 완전성 (data integrity) 교육 #1
- 최근 회사에서는 바로 일을 할 수 있는 사람을 원함. 하지만 신규 입사 지원자들을 실무와 관련된 정보를 얻기에 어려움이 있습니다.
- 제약, 바이오 회사 QC, QA 신입사원 지원자 대상, 데이터 완전성 (data integrity) 개념의 이해를 돕고자 정리하였습니다.
- 이번 글을 통한 개념 이해로 제약, 바이오 회사에 자기소개서 작성이나 면접 시 우위를 점할 수 있을 것으로 기대됩니다.
데이터 완전성 (data integrity) 배경 설명
2014년 FDA가 제약회사에 warning letter 발송하기 전, FDA에서는 이미 기자회견에서 미국에 판매되는 일반약 및 처방약의 두 번째 큰 공급업체가 인도임을 강조하고, 인도 제약사에 대한 실사 확대와 미국의 규제 기준 및 요구 사항에 충족해야 한다고 강조한 바 있다.
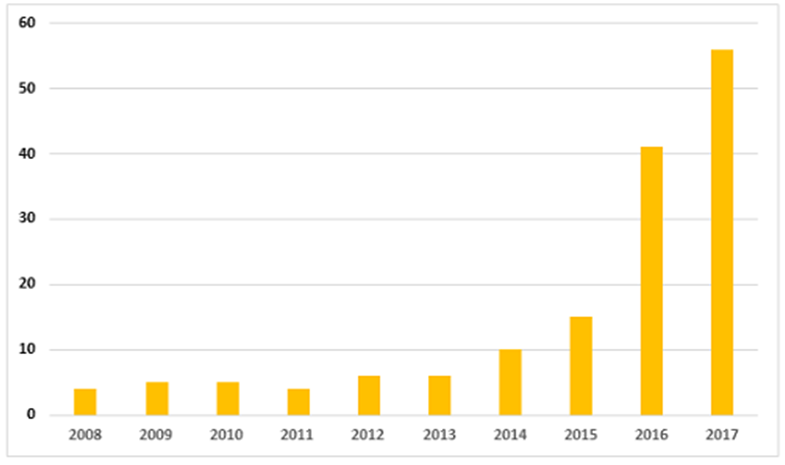
그리고 2015년도로 FDA에서 미국 이외 국가의 제약회사에 19건의 warning letter를 송부하면서 data integrity (DI)의 중요성이 화두가 되었다. 그리고 이중 15건이 data integrity와 관련된 것으로 79%의 비율로 data integrity의 중요성이 강조된 것이다.
2015년도 data integrity 관련 FDA warning letter
| No. | Company | Data of issue | Country |
| 1 | Micro Labs Limited | Jan. 9. 2015 | India |
| 2 | Apotex Research Private Limited | Jan. 30. 2015 | India |
| 3 | Navacyl Ltd | Feb. 27. 2015 | Thailand |
| 4 | Hospira Spa | Mar. 31. 2015 | Italy |
| 5 | Yunnan Hande Bio Tech Ltd | Apr. 6. 2015 | China |
| 6 | VUAB Pharma. a.s. | May. 27. 2015 | Czech republic |
| 7 | Mahendra Chemicals | Jul. 13. 2015 | India |
| 8 | Mylan Laboratories Limited | Aug. 16. 2015 | India |
| 9 | Pan Drugs Ltd | Sep. 2. 2015 | India |
| 10 | Unimark Remedies Limited | Sep. 28. 2015 | India |
| 11 | Sandoz Privated Limited | Oct. 22. 2015 | India |
| 12 | Dr. Reddy’s | Nov. 5. 2015 | India |
| 13 | Sun Pharmaceuticals Industries Ltd | Dec. 17. 2015 | India |
| 14 | Cadila Healthcare Ltd | Dec. 23. 2015 | India |
| 15 | Shajang Hisun Pharmaceutical Co. Ltd | Dec. 31. 2015 | China |
아래 연도별 FDA의 data integrity 관련 warning letter 발행 숫자를 보면 DI 중요성은 더욱 명확해진다.
<참고-FDA warning letter 조회 site>
cGMP (current GMP) 요구사항은 완전하고 정확한 data가 생성되고, 이를 문서화하는 것이다. FDA에서는 조작된 데이터 (거짓 데이터) 생성을 범죄로 간주한다. 이러한 FDA의 관점 변화에 따라 2015년 이후 유럽 (EMA), 한국 식약처 (MFDS)를 비롯한 각 국가의 규제 당국 실사 시 중점적으로 점검하고 있는 부분이 data integrity이다.
다만, 이러한 data integrity를 중요하게 보는 관점이 기존에 없던 규정을 신규로 만들어서 적용하는 것이 아니라, 실사 시 관점의 변화에 따라 중요성이 커지고 있는 것이다.
각 국가별 기관의 regulatory requirement
| US | Backup data are exact and complete, and secure from alteration, inadvertent erasures or loss |
| Data is stored to prevent deterioration or loss | |
| Certain activities are documented at the time of performance and that laboratory controls be scientifically sound | |
| True copies or other accurate reproductions of the original records. | |
| Complete information, complete data derived from all tests, complete record of all data, and complete records of all tests performed. | |
| EU | Access to clocks for recording timed events |
| Accessibility of batch records at locations where activities take place so that ad hoc data | |
| Control over blank paper templates for data recording | |
| User access rights which prevent (or audit trail) data amendments | |
| Automated data capture or printers attached to equipment such as balances | |
| Access to raw data for staff performing data checking activities | |
| 한국 | 시약부터 전체 의약품까지 사전, 사후 GMP 점검 시 평가 방안을 단계적으로 확대 추진. |
| 의약품 제조 및 품질관리의 데이터 관리범위와 인정 자료를 시험과정 전반에 걸쳐 생성되는 모든 자료로 확대 | |
| 데이터 조작 적발, 식약처가 제시한 평가 기준 미이행 시 무관용 원칙으로 행정처벌 (필요시 고발 병행) |
위 표에서 각 국가별 기관의 가이드라인으로 분류를 했지만, 결국 모든 가이드라인은 기존의 GMP 원칙인 데이터를 조작하지 않는 것과 그 증빙자료, 시스템의 중요성을 강조하고 있다.
신입사원으로 지원하는 분께서 FDA와 EU 가이드라인을 읽더라도 제약회사의 QC, QA의 실무를 모르고 가이드라인만 읽는 상황이기 때문에, 이해하기 어려운 것이 당연하다. 참고로 표에서 한국은 진행 방향만 정리하였는데, 식약처는 전반적으로 미국, 유럽의 가이드라인을 따라가는 방향이기 때문이다.