데이터 완전성 (data integrity) 교육 #4
6. Data integrity system 도입
Data integrity를 위한 system 도입은 아래와 같은 순서로 진행된다.
Risk assessment " Gap analysis " system 도입
6.1 Risk assessment (RA)
| [예시] 생산된 제품의 시험의뢰"시험 일정 확인"검체 채취"표준품, 검체 전처리"분석"분석결과 확인"계산 및 기준과 비교"적합/부적합 판정 |
Risk assessment는 각 단계별로 예상되는 위험요소 (risk)를 분류하고 그 위험 레벨을 low, medium, high로 분류하는 작업을 진행한다. Risk를 판단하는 기준은 PIC/S (Pharmaceutical Inspection Co-operation Scheme), EMA (European Medicines Agency), MHRA (Medicines and Healthcare products Regulatory Agency)에서 발행된 GMP data integrity guidance를 참고하여 진행한다.

PIC/S guidance 주요 사항
| 항목 | 세부내용 |
| System security | - Shared password must be prohibited |
| - Admin access should be controlled and general users should not have access to critical aspects of the software (e.g. system clocks, file deletion functions, etc) | |
| - System administrators should normally be in-dependent from users performing the task, and have no involvement or interest in the outcome of the data generated or available in the electronic system | |
| Audit trail | - Companies should endeavor to purchase and update software that includes electronic audit trail functionality |
| - The company’s quality unit should establish a program and schedule to conduct ongoing reviews of audit trails based upon their criticality and the system’s complexity | |
| Review of electronic data | - The review of data-related audit trails should be part of the routine data review within the approval process. |
| - Audit trail records should be in an intelligible form and have at least the following information: 1. Name of the person who made the change to the data 2. Description of the change 3. Time and date of the change 4. Justification for the change 5. Name of any person authorizing the change - The frequency, roles and responsibilities of audit trails review should be based on a risk assessment |
|
| - The regulated user should establish a SOP that describes in detail how to review audit trails | |
| Data capture /entry |
- Manual integrations and reprocessing of laboratory results must be performed in an approval and controlled manner |
| Data transfer between the systems | - Interfaces should be assessed and addressed during validation to ensure the correct and complete transfer of data |
| - Where system software is installed or updated, the user should ensure that archived data can be read by the new software | |
| - Where necessary this may require conversion of existing archived data to the new format | |
| Storage, archival and disposal of electronic data | - It is important that data is readable in its original form throughout the data lifecycle, and therefore users must maintain both the readability of data and access to superseded software |
| - Where conversion to the new data format of the new software is not possible, the old software should be maintained installed in one PC and also available as a hard copy |
6.2 Gap analysis
Gap analysis (갭 분석)을 통해서 구축하고자 하는 GMP 운영 현황, SOP의 부족한 점을 가이드라인과 비교하여 종합적으로 분석하고 보완 방향을 설정한다. 갭 분석의 예시는 아래와 같다.
Gap analysis 항목 예시
| 항목 | 세부항목 예시 |
| Management | - Awareness (senior management, employee, training) - Self inspection - Periodical review - Policy, SOP - OOS/Deviation - Randomly check for uncontrolled document and unofficial worksheet - Second person review - GMP document control - Issuing worksheet - Bonded form or loose sheet - Traceability about issue and re-issue - Control print of worksheet |
| Computerized system | - List up all computerized system - Networking or standalone - Security control (Limited entry / creation, change and cancellation of access authorization / control deletion of data and virus protection) - Computer validation - Change control for computer system - Back up (Frequency / period retention / CV) |
6.3 System 도입
| 항목 | 세부항목 |
| SOP 제정 및 개정 |
- Data integrity policy에 관한 SOP - System user 권한 관리 (각 시스템별 개별 권한 설정 필요) - Processing/review/storage (data review, integration 등) 분석 결과가 적합한지? Sequence 정보는 올바른지? 크로마토그램은 정상적인지? SST는 적합한지? Trial injection은 없는지? Integration은 적절하고 manual integration은 승인 없이 진행되지 않았는지? 크로마토그램의 scale은 적절한지? Audit trail에 특이사항이 있는지? 전자 data에 있는 모든 항이 출력되었는지? - Back up/archival/recovery/restoration (validation 및 기기별 back up에 대한 risk 확인 등) - OOS (out of specification) 및 deviation 시 원인 조사 및 처리 절차 |
| 시스템 도입 | - Network system - Access control 및 audit trail 갖추지 않은 기기 교체 (ex. 윈도우 로그인, 분석 기기 software 로그인 관리, soft ware 교체) - 시계 관리 (ex. 실험실 내 표준시계 배치, 분석 기기 표준 시간 설정, 시계에 대한 접근 권한을 제한, 시간 조작 위험성 제거) - 문서 발행시스템 (worksheet) (ex. Worksheet 발행 및 회수 절차를 LIMS에 적용, 데이터 기록을 위한 공양식 발행을 관리하여 모든 인쇄된 양식에 대한 관리) - 시약, 시액, 검체 관리 (ex. 검체 번호 발행 및 부착, 시약, 시액의 배치 번호 관리) - Excel 식에 대한 Qualification 및 HPLC software 사용 (ex. Excel 내 계산식 시트 확인, HPLC intelligent report 활용) |
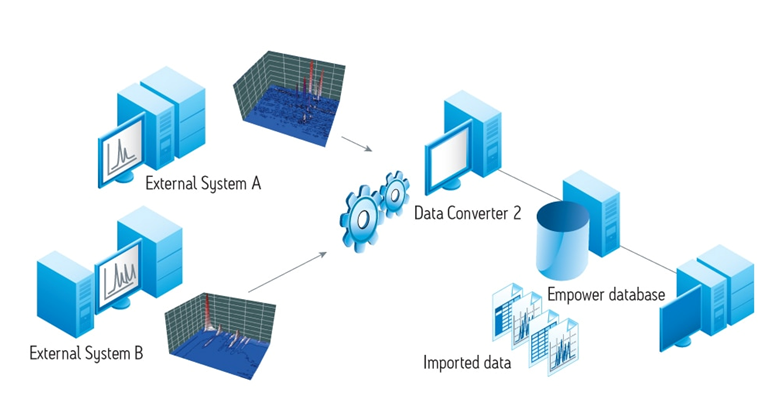
Network system 예시1: waters사 empower system
Network system 예시2: agilent사 ECM system
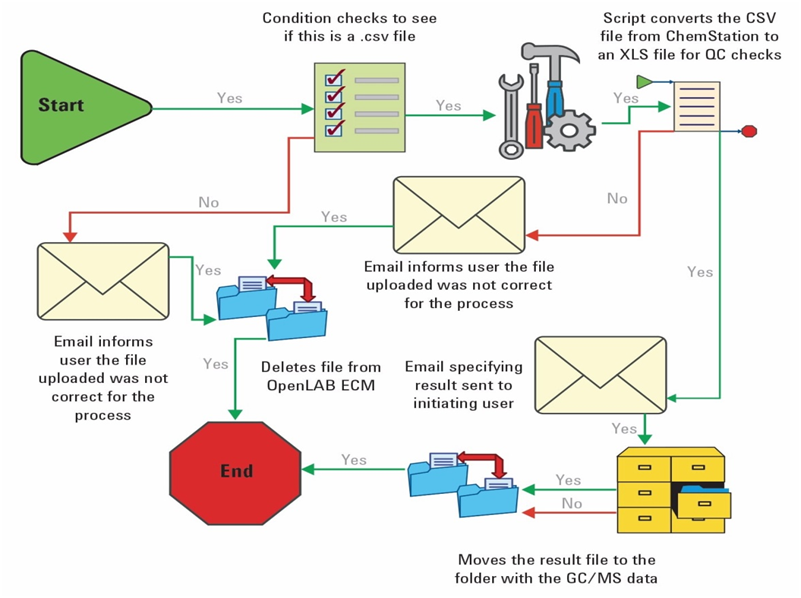
위 사례 이외에도 data integrity를 확보하기 위해 업무환경을 조성하는 노력 또한 추가될 수 있다.
- 생산 작업장, QC 실험실 내 문서 작성이 용이한 환경을 조성하여 임시로 데이터를 기록했다가 옮겨 적는 행위를 차단한다.
- 자동으로 생성되거나 프린트되는 데이터는 모두 기록서 등 문서에 첨부하도록 규정을 수립한다.
- 실제 작업이 가능한 범위 내에서 절차를 마련하여 규정을 위반하지 않도록 방지한다.
- 작업자, 시험자가 자발적으로 data integrity 이슈가 될 수 있는 실수나 부적절한 상황을 보고하고, 시정 조치 및 재발장지 조치가 진행될 수 있도록 유도한다.